质谱级赖氨酰肽链内切酶
Lysyl Endopeptidase®
- 产品特性
- 相关资料
- Q&A
- 参考文献
质谱级赖氨酰肽链内切酶
Lysyl Endopeptidase®

本产品是质谱分析前处理时常用的蛋白分解酶即赖氨酰肽链内切酶,该酶可以特异性切除赖氨酸基团C末端的多肽,可用于蛋白测序分析和 Lys-X 化合物的酶合成。若同时使用赖氨酰肽链内切酶和胰酶,可更好地切断赖氨酸基团的多肽,增加多肽的数量。产品已按照使用习惯做成小包装,是方便使用的冷冻干燥品。20 μg/支可用于100-200个样品的凝胶内消化。
来源:细菌
外观:冻干粉(包含2 mmol/L Tris-HCl 缓冲液,pH8)
活性:0.03~0.07 AU/vial
分子量:27,000(琼脂糖过滤),30,000(SDS-PAGE)
溶解性:溶于水或缓冲液
稳定性:溶解于 pH 值 5.0-12.0 的 Tris 缓冲液中,可在4℃稳定保存2年;在 pH 值 6.0-11.0、30℃时能稳定保存,但温度超过50℃时不稳定。
最适pH值:9.0~9.5
等电点:6.9~7.0
底物特异性:
可水解底物——Tos-Lys-OMe、Bz-Lys-NH2、Bz-Lys-pNA、Lys-pNA
不可水解底物——Bz-Arg-NH2、Bz-Arg-pNA、Arg-pNA
抑制剂:DFP、PMSF、TLCK
◆特点
● 高特异性、高蛋白质消化率、适用于蛋白质谱分析
● 提高裂解效率、增加肽段数量
● 根据使用量特意制备小包装,方便使用
◆应用
分别采用胰蛋白酶(Tp)、赖氨酰肽链内切酶(Lys-C)和 Tp与Lys-C 联用进行胶内酶切的效果比较。
牛血清蛋白 BSA 的条带(100 ng)通过 SDS-PAGE 获得,然后分别用 Tp、Lys-C 和 Lys-C+Tp 进行酶切,再用 MALDI-TOFMS 法进行分析。
这些蛋白酶的实验效果见下表。
表 1:Tp、Lys-C 和 Lys-C+Tp 的结果对照
这些结果表明 Lys-C 酶解的漏切位点数(Missed Cleavage)最少。Tp 酶解时加入 Lys-C 后,漏切位点数有所降低,同时,可以鉴定出更多的多肽。
|
Tp |
Lys-C |
Lys-C+Tp |
|
|
裂解位点 |
精氨酸和赖氨酸的C端 |
赖氨酸的C端 |
精氨酸和赖氨酸的C端 |
|
漏切位点数 (漏切位点所占比例) |
多(8%) |
很少(0%) |
少(3%) |
|
鉴定出的多肽数量 |
17 |
19 |
22 |
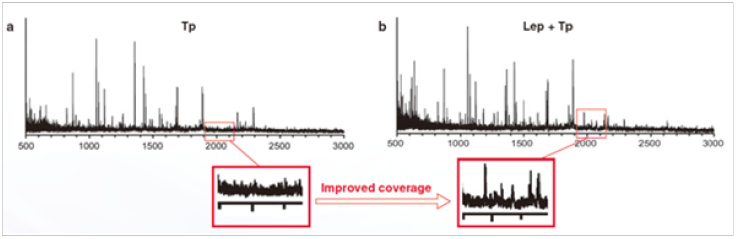
胰蛋白酶(Tp)(图 a)和赖氨酰肽链内切酶(Lys-C)+Tp( 图 b)酶切后的质谱结果对照图。
Lys-C+Tp 酶切后,可以在 m/z=2000 时得到吸收峰,而单独的 Tp 酶切在 m/z=2000 时没有吸收峰。该结果表明 Lys-C 可以提高测序覆盖度。
( 数据由大阪医疗中心和妇婴健康研究所Y. Wada 博士提供 )
赖氨酰肽链内切酶
赖氨酰肽链内切酶,最初由 Masaki 等人从土壤细菌中分离得到。该酶可以特异性剪切赖氨酸残基C末端和S-氨乙基半胱氨酸残基的肽键,用于蛋白测序和 Lys-X 化合物的酶催化合成。该酶稳定性高,在4M尿素或 0.1% SDS 溶液中 30℃ 孵育6小时之后,仍然拥有完整的生物活性。
|
外观 |
冻干粉(包含ca. 10% Tris-HCl buffer,pH 8) |
活性 |
见包装 |
|
分子量 |
27,000(凝胶过滤);30,000 (SDS-PAGE) |
溶解性 |
易溶于水或缓冲液 |
|
最佳pH |
9.0-9.5(酰胺酶的最佳活性 pH) |
等电点 |
6.9-7.0 |
|
抑制剂 |
DFP、PMSF、TLCK |
来源 |
细菌 |
|
稳定性 |
溶于pH 值 5.0-12.0 的缓冲液中,可于4℃稳定保存。溶于pH 值 6.0-11.0 的缓冲液中,可于30℃稳 定保存,但是50℃及以上不稳定。 |
||
|
单位定义 |
一单位酰胺酶(AU)指在30℃ pH 9.5 时每分钟产生1 μmol 对硝基苯胺所需的酶量。 |
||
|
底物特异性 |
水解底物:Tos-Lys-Ome、Bz-Lys-NH2、Bz-Lys-pNA、Lys-pNA |
||
|
非水解底物:Bz-Arg-NH2、Bz-Arg-pNa、Arg-pNA |
|||
※ 本页面产品仅供研究用,研究以外不可使用。
实验方法
1. 试剂:
A.0.2 mol/L AMP 缓冲液,pH值 9.5
溶解 4.2 g 的2-氨基-2-甲基-1,3-丙二醇于 150 mL 的水中,加入1 mol/L HCl 调 pH 值至 9.5,再加水使体积至 200 mL。
B.2.5 mmol/L 底物溶液
溶解 22.6 mg 的α-Benzoyl-DL-lysine-p-nitroanilide Hydrobromide(产品编号:024-19731)于 20 mL 水中。
C. 2 mmol/L Tris-HCl 缓冲液,pH8
溶解 0.24 mg的2-氨基-2-羟甲基-1,3-丙二醇于 900 mL 水中,加入 0.1 mol/L HCl 调pH值至8,再加水使体积至1 L。
D. 酶溶液
溶解1vial 的赖氨酰肽链内切酶于1mL 的溶剂C中,可直接加入。
E. 终止溶液
将 55 mL 水和 45 mL 乙酸混合均匀。
2. 步骤
|
试剂 |
检测样品 |
空白对照 |
|
A |
2.6 mL |
2.6 mL |
|
B |
0.3 mL |
0.3 mL |
|
30℃ 预培养5分钟 |
||
|
D |
0.1 mL |
– |
|
C |
– |
0.1 mL |
|
立即混合均匀,30℃ 预培养25分钟 |
||
|
E |
1.0 mL |
1.0 mL |
3. 单位的定义
酰胺酶单位是指 30℃、pH 9.5 时,每分钟产生1μmol 对硝基苯胺的酶量。
AU/vial = [(a-b) / 25] × (1/9.62) × (4.0/0.1)
a. 检测样品中的吸光度
b. 空白对照中的吸光度
胶内酶切的实验操作流程
用聚硅酮处理的微量离心管和吸管端防止捕获任何蛋白。使用质谱分析用凝胶染色试剂盒,例如银染剂 MS 试剂盒(产品编号:299-58901)和负凝胶染色 MS 试剂盒(产品编号:293-57701)
1. 电泳分离蛋白质样品;
2. 从凝胶中切割蛋白质片断并放入微量离心管;
3. 使凝胶脱色(可使用质谱分析用凝胶染色试剂盒中的脱色溶液);
4. 加入300 μL 乙腈到试管里,搅拌器振荡 30 分钟;
5. 去除乙腈,用 Parafilm 膜覆盖微量离心管。
6. 在 Parafilm 膜上打出针孔,真空干燥 15 分钟;
7. 100 μL 10 mmol/L DTT 溶解于 100 mmol/L 碳酸氢铵,56℃恒温1小时。
8. 室温冷却后,用等量的 50 mM 碘乙酰胺溶解于 100 mmol/L 碳酸氢铵,暗处恒温 45 分钟并涡旋;
9. 用 100 μL 100 mmol/L 碳酸氢铵洗涤凝胶片段 10 分钟;
10. 用 300 μL 乙腈干燥凝胶片段 15 分钟;
11. 用 100 μL 100 mmol/L 碳酸氢铵溶胀凝胶片段 15 分钟;
12. 用 300 μL 乙腈再次干燥凝胶片段 15 分钟;
13. 去除液相,真空干燥凝胶片段 15 分钟;
14. 用 100 μL 赖氨酸内切酶溶液*在冰水浴中溶胀凝胶片段 45 分钟;
*赖氨酸内切酶稀释于 50 mmol/L Tris-HCl pH 8.5;
15. 去除 100 μL 赖氨酸内切酶溶液,将凝胶片段放在 37℃、10 μL 50 mmol/L Tris-HCl pH 8.5 中过夜;
16. 加入 50 μL 20mmol/L 碳酸氢铵 20 分钟内振荡凝胶片段3次抽提多肽;
17. 加入 5% 甲酸/50% 乙腈 20 分钟内振荡凝胶片段3次抽提多肽;
18. 如果需要用 Speed Vac. 浓缩多肽;
19. 用 ZipTip 脱盐和纯化多肽;
20. 如果需要用弱真空浓缩多肽至2 μL;
21. 加入基质进行质谱分析。
注意:根据细菌的生理和形态特征分类,产品来源为水解无色杆菌,但是最近细菌分类学将这种细菌鉴定为产酶溶杆菌。
保存:暗处-20℃保存
规格:20 μg×5 vial
相关产品
| 产品编号 | 产品名称 | 包装 | 应用 |
| 202-15951 |
Trypsin, from Porcine Pancreas, Mass Spectrometry Grade 猪胰腺胰蛋白酶质谱级别 |
5×20 μg | 蛋白质组学 |
| 056-05921 | Endoproteinase Asp-N, Sequencing grade 胞内蛋白酶 Asp-N(测序级别) |
2 μg | 用于测序 |
| 050-05941 | Endoproteinase Glu-C, Sequencing grade 胞内蛋白酶 Glu-C(测序级别) |
50 μg | |
| 164-13982 | V8 Protease [Endoproteinase Glu-C] V8蛋白酶 |
2 mg | 生物化学 |

点击此处查看说明书.pdf

赖氨酰肽链内切酶,MS级
产品编号:125-05061
发表文献
[1] Ojima T et al. “Characterization of Halomonas Sp. Strain H11 {alpha}-Glucosidase Activated by Monovalent Cations and Its Application for Efficient Synthesis of {alpha}-D-Glucosylglycerol.” Applied and Environmental Microbiology 78, no. 6 (March 15, 2012): 1836–1845.
[2] Leitner A et al. “Expanding the Chemical Cross-Linking Toolbox by the Use of Multiple Proteases and Enrichment by Size Exclusion Chromatography.”Molecular and Cellular Proteomics 11, no. 3 (March 1, 2012): M111.014126.
[3] Goetze A et al. “Rates and Impact of Human Antibody Glycation in Vivo.” Glycobiology 22, no. 2 (February 1, 2012): 221–234.
[4] Thingholm, T et al. “Characterization of Human Myotubes From Type 2 Diabetic and Nondiabetic Subjects Using Complementary Quantitative Mass Spectrometric Methods.” Molecular and Cellular Proteomics 10, no. 9 (September 1, 2011): M110.006650.
[5] Shoji M et al. “walK and clpP Mutations Confer Reduced Vancomycin Susceptibility in Staphylococcus Aureus.” Antimicrobial Agents and Chemotherapy 55, no. 8 (August 1, 2011): 3870–3881.
[6] Kubota T et al. “Quantitative Proteomic Analysis of Chromatin Reveals That Ctf18 Acts in the DNA Replication Checkpoint.”Molecular and Cellular Proteomics 10, no. 7 (July 1, 2011): M110.005561.
[7] Lee E et al. “The Steady-State Repertoire of Human SCF Ubiquitin Ligase Complexes Does Not Require Ongoing Nedd8 Conjugation.” Molecular and Cellular Proteomics 10, no. 5 (May 1, 2011): M110.006460.
[8] Shirai Y et al. “Direct Binding of RalA to PKC{eta} and Its Crucial Role in Morphological Change During Keratinocyte Differentiation.” Molecular Biology of the Cell 22, no. 8 (April 15, 2011): 1340–1352.
[9] Liu D et al. “N-terminal Glutamate to Pyroglutamate Conversion in Vivo for Human IgG2 Antibodies.” Journal of Biological Chemistry 286, no. 13 (April 1, 2011): 11211–11217.
[10] Shen H et al. “Constitutive Activated Cdc42-associated Kinase (Ack) Phosphorylation at Arrested Endocytic Clathrin-coated Pits of Cells That Lack Dynamin.” Molecular Biology of the Cell 22, no. 4 (February 15, 2011): 493–502.
[11] Keinath N et al. “PAMP (Pathogen-associated Molecular Pattern)-induced Changes in Plasma Membrane Compartmentalization Reveal Novel Components of Plant Immunity.” Journal of Biological Chemistry 285, no. 50 (December 10, 2010): 39140–39149.
[12] Maeda T et al. “Purification, Characterization and Amino Acid Sequence of a Novel Enzyme, D-threo-3-hydroxyaspartate Dehydratase, from Delftia Sp. HT23.” Journal of Biochemistry 148, no. 6 (December 1, 2010): 705–712.
[13] Rajagopal C et al. “Secretion Stimulates Intramembrane Proteolysis of a Secretory Granule Membrane Enzyme.” Journal of Biological Chemistry 285, no. 45 (November 5, 2010): 34632–34642.
[14] Sato H et al.“Novel Isonitrile Hydratase Involved in Isonitrile Metabolism.”Journal of Biological Chemistry 285, no. 45 (November 5, 2010): 34793–34802.
[15] Manno S et al. “ATP-dependent Mechanism Protects Spectrin Against Glycation in Human Erythrocytes.” Journal of Biological Chemistry 285, no. 44 (October 29, 2010): 33923–33929.
[16] Matsumoto T et al. “Proteomic Analysis Identifies Insulin-like Growth Factor-binding Protein-related Protein-1 as a Podocyte Product.” Renal Physiology 299, no. 4 (October 1, 2010): F776–784.
[17] Sury M et al. “The SILAC Fly Allows for Accurate Protein Quantification in Vivo.” Molecular and Cellular Proteomics 9, no. 10 (October 1, 2010): 2173–2183.
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 125-05061 | Lysyl Endopeptidase®, MS Grade 赖氨酰肽链内切酶,MS级 |
20 μg×5 | 质谱级 | – |
| 121-05063 | Lysyl Endopeptidase®, MS Grade 赖氨酰肽链内切酶,MS级 |
20 μg | 质谱级 | – |
| 050-05941 | Endoproteinaseglu C, Sequencinggrade 测序级谷氨酰蛋白内切酶Glu-C |
50 μg | 生物化学分析级 | – |
| 202-15951 | Trypsin, from Porcine Pancreas, Mass Spectrometrygrade 猪胰腺胰蛋白酶质谱级别 |
20 μg×5 | 质谱级 | – |
|
|
